时间:2018-05-03 13:41
1
基因治疗,直面挑战
世界上第一个获得授权的基因转移研究诞生在1989年的NIH(National Insititutes of Health, 国立卫生研究院)。在这项标志性的研究中,肿瘤浸润的淋巴细胞被收集起来,用逆转录病毒进行遗传标记用于检查这些细胞的“肿瘤归巢”能力。这一研究为证明“遗传改变的人类细胞回输入病人体内后并不对人体造成伤害“提供了第一个直接证据。截止到2012年6月,全球已有31个国家共1843例临床试验已获授权、启动或已完结。回顾过往,2007年仅有28个国家的1309例临床试验,而2004年仅有24个国家的918例临床试验。有意思的是,尽管试验的总数量在逐步增长,但这期间的增长率却在轻微放缓。另外一个值得注意的差别在于进入临床试验晚期的试验比例,绝大多数的临床试验仍然停留在临床I期和临床I/II期。
这些绝大多数的早期临床试验为基因治疗提供了无价的概念验证,确认了对目标细胞定向改变能够成功的引起细胞表型的变化。然而在大多数的临床功能试验中,基因改造细胞的数量还不足以达到治疗的效果。尽管治疗效果欠佳的报告数量有所增加但基因治疗领域仍在继续发展。其中最值得注意的是几种疾病,如原发性免疫缺陷、莱伯先天性黑蒙症、血友病B、X连锁的肾上腺脑白质营养不良(X-ALD)的治疗。X-ALD是一种致命的脱髓鞘中枢神经系统疾病,一部电影《洛伦佐的油》使得这一疾病为人所知。这是慢病素载体被成功应用于治疗人类的基因缺陷病的首次报道,也是严重的中枢神经系统疾病治疗史上的巨大成功。 也有首次使用免疫治疗方法成功的临床试验报道,虽然接受治疗的患者人群在2012年还很少。这些试验中,患者接受了工程改造后能够识别肿瘤的T淋巴细胞,T淋巴细胞的这一功能是γ-逆转录病毒载体编码的直接针对肿瘤相关抗原的T细胞受体所赋予的。总体而言,临床反应变化多端,但重要的是,一小部分患者在接受治疗后得到了缓和。嵌合抗原受体(CARs)在2012年时,作为基于自身靶向肿瘤相关细胞表面抗原的自体细胞疗法进已进入临床。费城阿拉伯森癌症研究中心的研究人员描述了18例患有慢性淋巴细胞白血病的病人中3例在接受自体淋巴细胞治疗后获得的良好早期结果。 表1. 已获批的基因治疗药物 2 基因治疗的趋势与当前进展 CAR-T细胞 自2012年开始,全球新增基因治疗临床试验754例。其中最引人注目的领域当属利用CAR-T细胞靶向肿瘤相关细胞表面抗原的肿瘤的免疫治疗。这一方案已受到广泛关注,在许多其他肿瘤治疗方案已经失败的情况下它能够汇聚细胞毒T细胞的杀伤潜力和持久性与单克隆抗体的特异性以杀伤肿瘤。从2011年新英格兰医药杂志报道了一例病人接受转导了能够表达B细胞特异性抗原CD19的自体T细胞输注后达到完全缓解后,已有数百名患者在多次试验中接受了CAR-T 19 这一激动人心的治疗方式,在患有白血病或淋巴瘤尤其是急性淋巴白血病的患者中达到了前所未有的缓解率。这一疗法走向临床成为“免疫疗法”,被科学杂志评为2013年的突破性进展。值得注意的是,到2017年5月,Emily Whitehead 作为首个在费城儿童医院接受CAR-T细胞治疗的儿科患者已经5年没有复发,并且首个CAR-T细胞产品-Kymriah也在2017年被FDA批准上市。靶向实体瘤如胶质母细胞瘤是目前治疗中的一大挑战,相关报道正日益增加。 Cellectis正致力用TALEN技术编辑健康人来源的T细胞嵌合抗原受体(CAR),以利用健康人的血液获得“现成”的免疫疗法产品。这一通用CAR-T的临床试验于2017年2月获得FDA的批准,但由于出现受试者死亡案例,于2017年9月被FDA叫停。患者的死因指向了治疗靶点CD123的选择,而并不在于对“通用型”CAR的免疫反应,因两名患者均未报道有GvHD移植物抗宿主反应。目前这款通用型CAR-T的研发仍然处于不确定状态,但利用健康人血开发“通用”的肿瘤免疫疗法对于免疫力低下而无法在自身血液中获得足够的T淋巴细胞的肿瘤患者而言仍是一个重要的发展方向。 如今,美国已将CAR-T疗法纳入医保,FDA也批准了全球首款CAR-T疗法Kymriah的第二个适应症——复发或难治性大B细胞淋巴瘤。好消息仍在不断传来,cell杂志报道了一款SUPRA CAR-T。SUPRA CAR-T将T细胞从系统的靶点感知部分(the target-sensing portion of the system,SUPRA CAR-T系统中用于识别癌细胞上靶点的抗体部分)分离了出来,使系统拥有了切换靶点的能力。这一款通用型CAR-T是一种分离的、通用、可编程式(split,universal, and programmable,SUPRA)CAR 系统,用于T细胞治疗。能够很好地调控T细胞激活程度以消除毒性;能够感知多种抗原并做出响应以对抗癌症复发;还诱导控制细胞类型特异性的信号。这一系统的出现有望提供更安全、更有效的癌症治疗。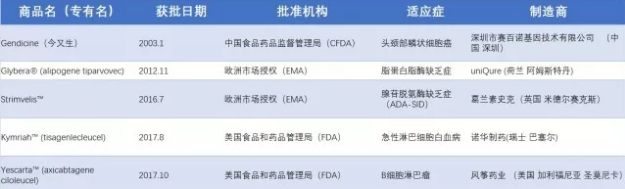

Cell(DOI: https://doi.org/10.1016/j.cell.2018.03.038)
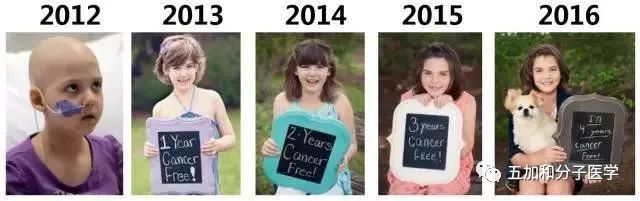
Emily Whitehead 2013-2016
单基因遗传病
自上次报道以来,单基因遗传病在治疗方面有了极大的稳步进展。截止2017年11月,11.1%的临床试验集中在单基因遗传病领域,而其在2012、2007和2004的历史数据分别为全部试验的8.7%、8.3%和9.8%。
非病毒载体
在囊性纤维化的治疗中,非病毒的基因治疗能够改善肺功能的概念已经一个随机的、双盲、安慰剂对照的临床IIB期试验验证。这一试验中,78例患者接受了阳离子脂质体包裹的编码CFTR cDNA的质粒DNA的转导。尽管收效甚微并且仅在个别受试者身上起效,但这一试验证明了其安全性并为未来试验的改进如增加剂量和频次打下了基础。
γ-逆转录病毒载体
针对免疫缺陷的临床试验仍在继续显示其显著的临床效果,超过150例合并缺陷患者接受了γ-逆转录病毒和最近基于慢病毒的基因转移治疗。在腺苷脱氨酶缺乏症(ADA-SCID)的治疗方面,超过40例患者接受了治疗,疾病的存活率超过70%。值得注意的是,Struimviv(葛兰素史克公司),基于里程碑式的米兰试验已于2016年获得了欧洲市场授权局(EMA)的市场批准,代表了第一个靶向干细胞的的基因治疗体外方案在欧洲获批。尽管经过长期的追踪在ADA-SCID的治疗中并没有观察到与载体的基因毒性相关的不良事件,但使用慢病毒进行治疗的临床试验逐渐增多。使用慢病毒对原发性免疫缺陷如X连锁重症免疫缺陷(X1-SCID)和Wiskott-Aldrich的治疗也有报道,并显示出相对于γ-逆转录病毒载体更好的安全性。
慢病毒载体
慢病毒载体在靶向造血干细胞治疗遗传性神经疾病ALD和异染性白质营养不良中的应用也取得了可喜的成果,并且类似的方法也被用于血红蛋白病的治疗,包括镰状细胞病患者的早期报道。在蓝鸟生物赞助的一项试验中,治疗后15个月,镰状球蛋白β抗体的水平约为β球蛋白的一半,疾病表征也得到了纠正。β地中海贫血的基因治疗,尤其是那些还残存β球蛋白表达的病人的治疗报道也令人充满希望,全球范围内目前已经开展了六项临床试验。2018年4月19日新英格兰医学杂志发表了哈佛医学院Leboulch等研究组用BB305载体转导的自体CD34 +细胞的基因治疗减少或消除了对22名患有严重β地中海贫血的患者长期红细胞输血的需要,而没有与药物产品相关的严重不良事件。这一里程碑式的试验成功新英格兰医学杂志的给予了高度赞赏,出版了专门的点评文章。目前世界上关于地中海贫血的基因治疗还有两粒临床试验正在进行中。由Meorial Solan Kattering医院主导的临床试验使用了相对温和的清髓预处理方法,也获得了与哈佛医学院相似的满意结果,而国内的地中海贫血基因治疗试验正在广州南方医院进行。 AAV载体 基于腺相关病毒(AAV)载体的治疗也在临床相显现了令人印象深刻的结果,这反映在一些专门的基因治疗期刊中关于这一载体系统的特征性讨论中。在这些试验中值得关注的包括α-1抗胰蛋白酶缺乏症、血友病A和B以及眼科疾病的基因治疗。用于治疗脂蛋白脂酶缺乏症的AAV载体在2012年获得EMA批准后已被uniQure公司市场化为Glybera。而美国第一个基于AAV的基因治疗产品voretigene neparvovec被Spark命名为Luxturna,获得了FDA咨询委员会的一致认可。该产品将人视网膜色素上皮特异性蛋白65 kDa(RPE65)cDNA递送到双眼视网膜下间隙治疗视网膜营养不良。在2017年10月19日,FDA授予了Luxturna的正式批文。 自2012年以来,血友病B(凝血因子IX缺失)的第二例临床试验已由A C Nathwani和其同事发起(皇家自由医院)。在该试验中,使用了血清型AAV8的病毒外壳以期比之前试验中使用的AAV2获得更高的基因表达率。关键的是AAV8较之AAV2在人群中的预存抗体水平更低。该实验中,外周静脉一次性注射表达凝血因子IX cDNA的由肝脏特异性启动子启动的AAV载体,能够将血浆中凝血因子IX水平提升至治疗水平(正常水平的1-6%),这一水平提升呈现剂量依赖性。高剂量注射能够观察到短暂的转氨酶水平升高,随后经皮质类固醇治疗好转。更多的血友病B的I/II期临床试验使用了天然存在的Padua亢进突变体进行。在这些试验中,在两个接受了高剂量载体注射的患者体内观察到了免疫反应导致的转基因表达下降,其中一个病人需要转向传统的凝血因子IX注射治疗,而且从另一方面来讲,尽管在10个受试者中观察到两个肝酶水平无症状的增加,但能够通过短期皮质类固醇治疗来解决。AAV9血清型的重组AAV病毒藉治疗神经性脊髓型肌萎缩症(SMA)162型和圣菲力波综合征A型(MPS IIIa)走向临床,说明这种病毒能够有效地跨越人的血脑屏障,在小鼠模型中也获得了一致的结果。
3
对基因治疗兴趣的恢复
近年来,产业和分出公司对基因治疗的兴趣前所未有,这反映了对这一领域信心的增加。这些信心来源于基于治疗效果的越来越多的报道和首批基因治疗产品如EMA2012年批准的Glybera®(uniQure)和2016年治疗ADA-SCID的SrimoSmithLe(葛兰素史克)的上市。更近一些,诺华研发的首个CAR T细胞治疗产品Kymriah(之前名为tisagenlecleucel-T 和CTL019)于2017年8月获FDA批准。紧接着,由Kite Pharma研发的商品名为Yescarta的CAR-T治疗产品和Spark Therapeutics 的Luxturna分别在10月和12月获得FDA批准上市。学术界也获得了越来越多的行业资助,进一步拓展了基因治疗药物的研发管线。随着临床思维的变革,大量的投资开始进入基因治疗领域,如优化生产工艺以扩大获得治疗人类疾病所需的病毒载体的生产规模并确保商业化的生产方法对新载体适用。国内方面,五加和对中国的基因治疗提供AAV、HSV、LENTI、ADV载体系统中试及规模化载体生产平台,可以为基因治疗产业快速发展提供支撑。临床医药中基因治疗的信心增加也引发了生物医药领域对于潜在获利的疾病指征的激烈竞争,以利用AAV载体治疗凝血因子缺乏的血友病A和血友病B为例,至少10家公司分别启动或宣称计划开展临床试验。
4
进化的技术与新的基因治疗平台
基因修复
自2012年以来,一个重要的模式变化在于更多的关注集中在基因补充策略的改变,包括基因编辑和目标基因重组,反义寡核苷酸诱导外显子跳跃以及RNA干扰,这些方案现已全部进入临床。在简单增加功能正常的基因不足以改善的显性疾病过程中,这一策略非常重要。RNAi的重要性(例如基因下调基因表达)在2006和梅洛获得诺贝尔生理和医学奖时被认可。虽然这些方法的效率通常不足以进行人类疾病的基因治疗,但在使用寡核苷酸诱导的外显子跳跃治疗假肥大型肌营养不良症(DMD)方面和关于SMA治疗的典型案例已被报道出来并在最近的分子治疗周年纪念版中进行了综述。2016,FDA批准了两种剪接调节寡核苷酸用于治疗神经肌肉疾病。第一个是Eteplirsen (Sarepta Therapeutics),尽管有争议但仍获得了FDA的优先审批,用磷酰二胺吗啉反义寡核苷酸治疗DMD。而用于治疗SMA患者的nusinersen (由Biogen市场化的Spinraza)则在提出新药申请后3个月就被接收,并且不需转至FDA咨询委员会。 基因编辑 自第一个特异性的核酸酶被证明能够结合DNA并使双链断裂以来已近二十年的时间,这极大的促进了位点特异性基因编辑的发展。核酸酶诱导的基因断裂不仅可以用基因添加和基因破坏,还可用于基因修复。尽管需要长期随访,但基因编辑技术的前景看好,这一技术已被应用于治疗HIV-193和转录激活因子样效应核酸酶的临床试验中,用以治疗两个患有晚期白血病的儿童。最近,一种用于细菌免疫系的规则相间的短回文重复基因簇相关cas9(CRISPR/CAS9)核酸酶显著提高了基因组编辑的效率,尽管在30年前首次被报道时仅被作为iap基因下游的一组不寻常核苷酸序列。这一细菌免疫系统被重新定义,导致了基因编辑技术的持续革命。根据报道,为了生产更安全的异种移植组织,CRISPR/Cas9已被用于超过60种猪内源性逆转录病毒的灭活中。最近,CRISPR/CAS9修饰的细胞首次用于人类治疗癌症。2016年10月28日,四川大学卢勇团队将CRISPR/Cas9改造的T细胞输入病人体内以治疗转移性肺癌(试验号NCT02793856),国内还有另外7个针对实体瘤的临床试验计划进行。SangaMo疗法也开始使用锌指核酸酶将序列导入白蛋白位点治疗粘多糖沉积症和血友病B(试验号分别为:NCT03041324, NCT02702115 和 NCT02695160)。尽管仍处于临床前阶段,但使用非同源末端纠正致病性剪接位点突变已被报道用于治疗小鼠1A性先天性肌营养不良症并在一些案例中可能最终取代使用寡核苷酸诱导的外显子跳跃。该技术的进一步改进,如鉴定具有减少的靶向效应的替代核酸酶,已经显示了其基因治疗应用的潜力,但对大量的细胞进行精准的位点修复以获得治疗效果仍是对现有技术的挑战。最开始利用CRISPR/Cas9对人类胚胎进行基因编辑的是中国,最近美国也有相关报道。 日益增长的转基因表达需求 基因传递系统可分为两大类:非病毒的物理化学方法与重组病毒系统。非病毒方法的比较优势包括化学特性的简化、生产的简单性和再现性、更大的包装容量和能减少生物安全方面的担忧。然而与重组病毒系统相比非病毒方法相对低效且往往效果短暂。然而核酸稳定性和效力的提高以及脂质和聚合物递送技术的进步,正在推进非病毒基因递送系统的发展。相较与此,为了使病毒系统复制能力缺失、效率更高以及更好的利用其有利的一面,病毒系统常有修改。根据所需修饰的性质,核酸、寡核苷酸、适体、转录因子和其他分子的瞬时递送是非常可能实现的。例如,使用非整合载体、瞬时表达系统和小分子将转录因子传递到诱导多能干细胞(iPS),其安全性问题的解决在于消除编码转录因子不必要的长期表达和插入诱变的可能性。通过限制潜在的脱靶效应,Cas9和其他DNA内切酶在基因组编辑中的瞬时表达也可能是有利的,这正在被广泛地研究。